 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
CIRCULAR 00000029 DE 2025
(agosto 27)
Diario Oficial No. 53.227 de 29 de agosto de 2025
Diario Oficial disponible en la web de la Imprenta Nacional de Colombia el 30 de agosto de 2025
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
| Para: | Gobernadores, Alcaldes, Secretarios Departamentales, Distritales y Municipales de Salud, Entidades Promotoras de Salud, Entidades Adaptadas, Entidades que administran los Regímenes Especial y de Excepción, Instituciones Prestadoras de Servicios de Salud (IPS) y Fondo Nacional de Salud de las Personas Privadas de la Libertad. |
| De: | Ministerio de Salud y Protección Social |
| Asunto: | Directrices para la vacunación de la población gestante contra la fiebre amarilla a partir de la semana 12 de gestación, residente en zonas de muy alta circulación del virus y transmisión activa del brote, previa valoración riesgo/beneficio. |
| Fecha | 27 de agosto de 2025 |
El Ministerio de Salud y Protección Social (MSPS), en ejercicio de sus funciones, como órgano rector del Sector Salud, encargado de la dirección, orientación y conducción del Sistema de Salud de acuerdo con lo establecido en el Decreto Ley 4107 de 2011, considera necesario emitir la presente Circular externa e impartir las siguientes directrices de obligatorio cumplimiento por parte de los destinatarios, para brindar protección a la población gestante que resida o transite en áreas de muy alta circulación viral y brote activo con casos humanos o epizootias de fiebre amarilla.
ASPECTOS PRELIMINARES.
El virus de la Fiebre Amarilla (en adelante FA) es un arbovirus del género Flavivirus transmitido por mosquitos de los géneros Haemagogus y Sabethes relacionado con transmisión selvática, y Aedes relacionado con transmisión urbana, de alto poder epidémico, con una letalidad de hasta 75% en brotes, considerándose entre las más altas de las enfermedades transmisibles y prevenibles por vacunación. Dado su poder epidémico y su alta letalidad, sin cura, ni tratamiento específico, la inmunización es una de las intervenciones de salud pública más eficaces y costo-efectivas para su prevención, además, se considera como evento de Interés en Salud Pública Internacional en el marco del Reglamento Sanitario Internacional (RSI) de 2005(1).
El 23 de mayo de 2025 la Organización Panamericana de la Salud (OPS) emite la evaluación de Riesgo para la Salud Pública relacionado con la situación de fiebre amarilla en la Región de las Américas, concluyendo que el riesgo general relacionado con la situación de fiebre amarilla en la Región de las Américas, especialmente en los países endémicos, se clasifica como “Alto” con un nivel de confianza “Alto” basado en la información disponible.
El 31 de mayo del 2025 la OPS, emitió la “Alerta Epidemiológica Fiebre amarilla en la Región de las Américas”, considerando el aumento de casos humanos, siendo confirmados al 25 de mayo, 235 casos en la región, incluyendo 96 defunciones, en Bolivia, Brasil, Perú, Colombia y Ecuador; haciendo un llamado a los Estados Miembros a continuar fortaleciendo la vigilancia en zonas enzoóticas, vacunar a las poblaciones en riesgo y tomar las acciones necesarias para garantizar que viajeros que se dirigen a zonas donde se indica la vacunación, estén correctamente informados y protegidos contra la fiebre amarilla(2).
En Colombia, en el contexto de la Emergencia en Salud Pública por brote de fiebre amarilla, a nivel nacional entre enero del 2024 y en lo corrido del 2025, se han confirmado 125 casos con 48 fallecimientos, con una letalidad acumulada del 36,8%, del periodo acumulado entre el 3 de enero de 2024 al 30 de julio de 2025.
Para el año 2024 se presentaron 23 casos con 13 fallecimientos y letalidad del 56,5% y desde el 1 de enero al 30 de julio de 2025, se han confirmado 102 casos y 2 casos procedente del exterior (Apure – Venezuela), de los cuales, 40 han fallecido (33 confirmados como causa de muerte fiebre amarilla), con una letalidad del 32,4% (33/102).
De acuerdo con la procedencia de los casos, acumulado 2024 y al 30 de julio de 2025, se registran 125 casos, los cuales se distribuyen en 10 departamentos. Respecto al Tolima, se reportaron 105 casos en 12 municipios afectados: Ataco (23), Villarrica (19), Prado (17), Cunday (17), Chaparral (8), Purificación (6), Dolores (4), Rioblanco (7), Ibagué (1), Palocabildo (1), Valle de San Juan (1) y Espinal (1). También se reportan casos en Putumayo (Orito 4, Villa Garzón 2, San Miguel 1, Valle del Guamuez 1), Meta (San Martín 1, Granada 1, La Macarena 1), Caquetá (Cartagena del Chairá 1, El Doncello 1), Nariño (Ipiales 2), Vaupés (Mitú 1), Caldas (Neira 1), Cauca (Piamonte 1), Huila (Campoalegre 1), Guaviare (San José del Guaviare 1) y 2 casos procedentes del exterior (Apure-Venezuela).
Con respecto a la identificación de epizootias de fiebre amarilla en el país, al 30 de julio de 2025, se han confirmado 65 casos de fiebre amarilla en PNH (primates no humanos) distribuidos así: 48 con procedencia de Tolima en los municipios de Chaparral (17), Ataco (10), Planadas (6), San Antonio (5), Rioblanco (4), Villarrica (3), Cunday (2), Purificación (1); ocho (8) casos procedentes del Huila en los municipios de Neiva (3), Palermo (3) y Aipe (2); ocho (8) casos procedentes de Putumayo en los municipios de Mocoa (6), Orito (2) y un (1) caso procedente de Meta en el municipio de Villavicencio.
Para atender la situación de emergencia por fiebre amarilla el Ministerio de Salud y Protección Social (en adelante MSPS) a través de la Circular 18 de 2024 emitió directrices para la preparación, organización y respuesta ante la situación de alerta y emergencia en todo el territorio nacional por fiebre amarilla. Mediante las Circulares número 002 de 2025 y número 005 de 2025 determinó la vacunación de la población a partir de 9 meses, incluyendo mayores de 59 años, en los municipios del corredor endémico del departamento del Tolima. Debido a la evolución de la situación del brote se expidió la Circular número 12 de 2025 que organiza y actualiza las directrices para la preparación, organización y respuesta ante la situación de alerta y emergencia en todo el territorio nacional por fiebre amarilla y derogó las Circulares anteriores. A su vez, con la Circular número 14 de 2025 se establecen instrucciones para mitigar los riesgos en temporada de semana santa y por su parte, a través de la Circular número 025 de junio de 2025 este Ministerio impartió instrucciones para vacaciones, ferias y fiestas.
Mediante la Resolución número 691 de 2025 se declaró la Emergencia Sanitaria en todo el territorio nacional por el brote causado por el virus de la fiebre amarilla y se adoptaron medidas para su prevención y control que complementan y ajustan las disposiciones emitidas mediante las Circulares Externas número 012 y 014 de 2025, expedidas por el MSPS.
En los términos de la Resolución número 691 de 2025 se clasifican los municipios de conformidad con el nivel de riesgo, situación dinámica, atendiendo a las condiciones ecoepidemiológicas. En aquellos municipios denominados de muy alto riesgo (148 municipios) y alto riesgo (254 municipios), la resolución impartió la instrucción de vacunar a toda la población a partir de los 9 meses de edad en adelante. Por su parte, en los municipios clasificados en bajo riesgo (720 municipios) la población objeto de vacunación corresponde a quienes tengan un rango etario entre los 9 meses a 19 años de edad que no hayan recibido la vacuna previamente. Adicionalmente, la resolución determina que se deberá vacunar a aquellos viajeros que se desplacen a municipios de muy alto y alto riesgo.
En el país, desde el 1 de septiembre de 2024 al 28 de julio de 2025, se han vacunado contra la fiebre amarilla 3.639.875 personas. En este mismo periodo, en los 148 municipios caracterizados de Muy Alto Riesgo, clasificados así por tener circulación activa del virus y presencia de casos humanos o epizootias, incluidos, municipios aledaños y corredores ecoepidemiológicos, con una población susceptible estimada de 1.374.146 personas, se han vacunado 1.240.981 personas alcanzando una cobertura del 90% de la población susceptible, y en los 254 municipios de Alto Riesgo, clasificados así por tener condiciones ambientales para la ocurrencia de casos pero sin casos activos, se estimó una población susceptible de 2.562.171 personas, de las cuales se han vacunado 890.793, obteniendo una cobertura del 35% de la población susceptibles al 28 de julio del presente año.
A su vez, en los 720 municipios de Bajo Riesgo, sin condiciones actuales para brote del virus de fiebre amarilla, reportan una población vacunada de 1.508.101 personas.
Por otro lado, con relación al seguimiento de la no vacunación por disentimientos y contraindicaciones, se identifican 277 gestantes sin vacunar en veredas con circulación viral activa del virus de fiebre amarilla y brote persistente con casos humanos y epizootias en municipios de Ataco, Rioblanco, Chaparral y San Antonio del departamento del Tolima, generándose un gran riesgo para esta población, que reside o transita por estas áreas.
Según la Organización Mundial de la Salud (OMS), en su “Documento de posición sobre Vacunas y vacunación contra la fiebre amarilla de junio de 2013”, indica: “Habida cuenta de que la vacuna contra la FA se elabora con virus vivos, es necesario sopesar los riesgos y los beneficios antes de administrarla a embarazadas o mujeres lactando. En las zonas donde la FA es endémica o durante los brotes de esta enfermedad, es probable que los beneficios de la vacunación compensen sobradamente el riesgo de transmisión del virus vacunal al feto o el lactante. Las embarazadas y las mujeres lactando deben recibir asesoramiento acerca de los riesgos y los beneficios de la vacunación para que puedan tomar una decisión fundamentada al respecto. Se ha de informar a las mujeres lactando de que los beneficios de la lactancia sobrepasan con creces otras alternativas, sin embargo, se recomienda la vacunación de las embarazadas y las mujeres lactando que estén por viajar a zonas endémicas cuando dicho viaje no pueda evitarse ni postergarse. La vacuna está contraindicada en los menores de 6 meses y no se recomienda su administración a niños de 6–8 meses, salvo durante las epidemias, cuando el riesgo de infección por el virus de la FA puede ser muy alto”(3).
De acuerdo con el concepto suministrado por la Organización Panamericana de Salud (OPS)(4), las mujeres embarazadas y las que están en su periodo de lactancia son consideradas también grupos de población con indicación de precaución para la vacunación contra la fiebre amarilla, por lo tanto, no se recomienda vacunar, excepto cuando existe un mayor riesgo de enfermar de fiebre amarilla, como puede ser el caso de un alto riesgo de brote o de viaje inevitable a zonas endémicas. Se podrá considerar la administración de la dosis estándar de la vacuna para lo cual se debería considerar también la intensificación de la vigilancia activa de los eventos adversos en estos casos. Se ha observado una mejor respuesta inmunológica, en términos de porcentaje de anticuerpos neutralizantes, cuando la vacuna se recibe en el primer trimestre del embarazo (98%) que cuando se recibe en el tercer trimestre (39%). Tanto las mujeres embarazadas como las madres lactantes con alto riesgo de contraer la fiebre amarilla deben recibir asesoramiento sobre los beneficios y los riesgos potenciales de la vacunación para que puedan tomar una decisión informada. Se dispone de pocos estudios sobre fiebre amarilla y embarazo, pero se ha descrito la transmisión perinatal de la enfermedad. La mayoría de la información disponible, se basa en estudios en mujeres embarazadas vacunadas inadvertidamente, en los cuales no se han encontrado diferencias con población general en relación a eventos obstétricos como abortos espontáneos, parto pretérmino, muerte neonatal o malformaciones congénitas.
Con base en lo anterior, el 17 de julio de 2025 se llevó a cabo un comité de expertos liderado por el Instituto Nacional de Salud, en la que se socializó la situación actual y se evaluaron estudios y posiciones de diferentes organismos nacionales e internacionales.
Atendiendo a las indicaciones dadas en dicho Comité(5), junto con la evidencia científica disponible y el porcentaje significativo de población gestante susceptible en zonas de brote activo, este Ministerio de Salud y Protección Social emite la presente Circular con instrucciones para la vacunación contra la fiebre amarilla en población gestante susceptible a partir de la semana 12 de gestación, previa valoración médica individualizada de riesgo/beneficio y consentimiento/disentimiento informado, acorde a lo enunciado en el numeral “10.10 Embarazo y lactancia” del “Lineamiento para la vacunación contra la fiebre amarilla en el marco de la emergencia sanitaria Colombia, Versión 2, Mayo de 2025”, expedido en el marco de la Resolución número 691 del 16 de abril de 2025.
INDICACIONES PARA LA VACUNACIÓN CONTRA LA FIEBRE AMARILLA EN GESTANTES Y MADRES LACTANDO HIJOS MENORES DE 6 MESES
Se deberá ofrecer la vacunación contra la fiebre amarilla a la población gestante a partir de las 12 semanas de gestación, sin antecedente de vacunación contra fiebre amarilla, residentes o que no les sea posible evitar la permanencia o desplazamiento a veredas con circulación activa del virus de fiebre amarilla, es decir las veredas con evidencia de casos humanos o epizootias en los últimos seis meses, incluyendo las establecidas en el corredor ecoepidemiológico. Para la vacunación de gestantes se requiere valoración médica individualizada de riesgo/beneficio y diligenciamiento del consentimiento/disentimiento informado previa a la aplicación de la vacuna.
Las madres que amamantan pueden ser vacunadas si residen o se trasladan a zonas con transmisión activa del virus salvaje de la fiebre amarilla. Tras la vacunación, cuando el lactante es menor de 6 meses, la lactancia debe suspenderse por al menos 10 días (fase de viremia posterior a la vacuna). En los mayores de 6 meses no es necesario interrumpir la lactancia.
Se requiere fortalecer las medidas de vigilancia activa de Eventos Adversos Posteriores a la Vacunación (EAPV), especialmente, en mujeres embarazadas y lactantes vacunados, implementando un monitoreo sistemático en cohortes de gestantes vacunadas, ya sea de forma inadvertida o como parte de la estrategia de vacunación en zonas de riesgo epidemiológico.
La vigilancia farmacológica estará a cargo del INVIMA según lo normado en el “Lineamiento general para la gestión de eventos adversos posteriores a la vacunación (EAPV), asegurando cumplimiento de la notificación, investigación de campo, investigación farmacológica, investigación de punto de vacunación, entre otros, así como, el análisis y validación por parte del comité de expertos territorial de EAPV”(6).
El INS continuará la vigilancia de los eventos relacionados con fiebre amarilla y orientará de manera prioritaria a las entidades territoriales y a sus respectivos equipos de vigilancia en salud pública de su participación en la investigación de los casos de EAPV en población gestante, con el propósito de identificar patrones epidemiológicos, factores de riesgo ambientales y posibles brotes en la comunidad que puedan haber causado el caso de ESAVI, diferenciándolo de otros eventos de salud pública.
Para poder identificar tempranamente eventos de interés durante la gestación, se deberá asegurar un seguimiento post vacunación que permita la generación de información sobre la seguridad de la vacuna hasta el parto y del recién nacido hasta un mes posparto. Esto en coherencia con el protocolo que defina el INVIMA para tal fin. También se tendrá precaución para generar mensajes que expliquen muy bien cuáles son las situaciones que llevarían a considerar la vacunación de gestantes, aclarando que no corresponde a una recomendación para vacunación masiva en esta población, sino a la población con muy alto riesgo de fiebre amarilla según los criterios de circulación activa del virus mencionado previamente.
Las EPS e IPS deben implementar un seguimiento clínico periódico a las gestantes vacunadas, desde la aplicación de la vacuna hasta el posparto, incluyendo la vigilancia de sospecha de eventos adversos asociados, y reporte al INS y al INVIMA. Se debe establecer una vigilancia activa del neonato hijo de mujeres vacunadas durante el embarazo o la lactancia sobre la detección de posibles eventos adversos asociados a la vacuna de fiebre amarilla.
La vacuna contra la fiebre amarilla se prefiere aplicar de manera independiente a partir de la semana 12 de gestación.
Se requiere fortalecer la capacitación al personal vacunador en el abordaje de mujeres gestantes y en lactancia, en la evaluación médica individualizada riesgo/beneficio, en el diligenciamiento del consentimiento/disentimiento informado, así como, en el seguimiento clínico posvacunación, los respectivos controles prenatales de las gestantes y los controles de los hijos de madres vacunadas.
Establecer mecanismos para identificar mujeres vacunadas inadvertidamente durante la gestación y garantizar el seguimiento de las mujeres y sus hijos, de acuerdo al protocolo estándar.
Promover estrategias de comunicación de riesgo con enfoque diferencial y territorial.
1. A las gobernaciones, alcaldías, secretarías de salud o entidad que haga sus veces (departamentales, distritales y municipales).
1.1 Elaborar e implementar el plan de acción territorializado para la vacunación de población gestante, liderado por la Entidad Territorial de salud (departamental y municipal), en articulación con los equipos territoriales del programa de Enfermedades Transmitidas por Vectores (ETV), Vigilancia Epidemiológica, el Programa Ampliado de Inmunizaciones (PAI), las Entidades Administradoras de Planes de Beneficios (EAPB), las Instituciones Prestadoras de Servicios de Salud (IPS) y demás actores responsables. Este plan debe priorizar la vacunación de mujeres gestantes a partir de las 12 semanas de gestación sin antecedente de vacunación contra FA, residentes o que no les sea posible evitar la permanencia o desplazamiento a veredas con circulación activa del virus de fiebre amarilla, es decir las veredas con evidencia de casos humanos o epizootias en los últimos seis meses, con especial énfasis en aquellas áreas con barreras de acceso a los servicios de salud. Para la vacunación de gestantes se requiere valoración médica individualizada de riesgo/beneficio y diligenciamiento del consentimiento/ disentimiento informado previa a la aplicación de vacuna y el plan debe incluir los recursos necesarios para garantizar el acceso efectivo y oportuno a esta intervención y el seguimiento posvacunal.
1.2 Participar en la elaboración de la microplanificación del territorio, en conjunto con las EAPB y su red prestadora de servicios de salud, incluyendo la georreferenciación y programación de las veredas priorizadas, estableciendo las estrategias y tácticas necesarias, así como, el talento humano que garantice la vacunación en gestantes. Dicha herramienta de planeación se debe realizar de manera articulada con el equipo territorial del programa de ETV, Vigilancia Epidemiológica y PAI, quienes indicarán el corredor eco epidemiológico del virus para la priorización del área rural de muy alta circulación y transmisión viral y priorizar así, la vacunación de gestantes que habiten o transiten en esta zona, y que no sea posible movilizarlas temporalmente a sitios con menor riesgo.
1.3 Vigilar que las EAPB e IPS garanticen la atención, vacunación y seguimiento respectivo, sin barreras de la población gestante vacunada contra la fiebre amarilla y los hijos de madres vacunadas con este biológico, de acuerdo con las indicaciones dadas en la presente circular, dando cumplimiento a la Ley 2406 de 2024 “Por medio de la cual se ordena la Modernización y Actualización permanente del Programa Ampliado de Inmunizaciones (PAI) (…)”.
1.4 Los departamentos y distritos con veredas de circulación activa del virus de la fiebre amarilla, deben remitir informe que contenga el monitoreo de los indicadores establecidos en la presente circular y el desarrollo cuantificado de las actividades establecidas en el Plan de Acción de vacunación de la población gestante, a las siguientes áreas del MSPS: 1. Dirección de Promoción y Prevención, Subdirección de Enfermedades Transmisibles, Grupo Gestión Integrada de Enfermedades Inmunoprevenibles (PAI), 2. Dirección de Prestación de Servicios y Atención Primaria 3. Dirección de Regulación de la Operación del Aseguramiento en Salud, Riesgos Laborales y Pensiones, en los primeros diez (10) días hábiles de cada mes.
1.5 Fortalecer la vigilancia en salud pública en la red de prestación de servicios de salud para garantizar la captación y notificación inmediata al SIVIGILA de cualquier caso grave probable o confirmado de FA en población gestante vacunada y en los hijos de madres vacunadas con este biológico, incluyendo muertes, de acuerdo con los lineamientos establecidos por el Instituto Nacional de Salud.
1.6 Ante la sospecha de Eventos Adversos Posteriores a la Vacunación (EAPV) por la vacuna contra la fiebre amarilla graves, incluyendo muerte, en población gestante vacunada y en los hijos de madres vacunadas con este biológico, incluyendo las gestantes vacunadas inadvertidamente, se notifican al SIVIGILA y al VIGIFLOW dando cumplimiento a todas las instrucciones dadas en los protocolos de Vigilancia para FA del INS y de EAPV del INVIMA en lo concerniente a las acciones de investigación de EAPV grave y análisis de causalidad de dichos eventos.
1.7 Se debe garantizar la disponibilidad de los referentes de Farmacovigilancia en la entidad territorial, y la participación y coordinación con los responsables del área de inmunizaciones y de vigilancia epidemiológica para el despliegue de las investigaciones de eventos graves principalmente. Las entidades territoriales deben contar con un comité departamental de expertos, entrenado en la metodología de la OMS, para la evaluación de causalidad de los eventos graves que ocurran en su jurisdicción.
1.8 Hacer seguimiento activo de dosis aplicadas contra la FA a la población gestante por parte de los prestadores de servicios de salud y realizar el reporte diario administrativo por PAIWEB.
1.9 Realizar seguimiento al cumplimiento del registro obligatorio y oportuno de dosis aplicadas, así como el registro de las observaciones pertinentes, por parte de los prestadores, en el sistema de información nominal de vacunación PAIWEB diariamente y verificar la calidad del dato de las dosis registradas.
1.10 Realizar capacitación al talento humano de las IPS y Equipos básicos de Salud sobre la vacunación de gestantes, hijos de gestantes vacunadas con FA e hijos de madres vacunadas con FA en periodo de lactancia antes de 6 meses de edad cronológica del bebé.
1.11 Verificar que las EAPB garanticen, a través de su red de prestación de servicios, el talento humano profesional en medicina, capacitado para realizar la valoración y consejería médica individualizada riesgo/beneficio de la población gestante en zonas de circulación activa del virus a vacunar contra la fiebre amarilla, con el fin de identificar antecedentes y condiciones de salud que pudiesen contraindicar la vacunación, propendiendo por el control de reacciones anafilácticas y eventuales EAPV, así como, los dos respectivos seguimientos posvacunales entre el día 15 y 18 y día 30 posterior a la vacunación y registro, incluyendo a las gestantes vacunadas inadvertidamente, para identificar signos y síntomas sospechosos de EAPV, y generen la atención domiciliaria u hospitalaria pertinente y oportuna, así como las respectivas notificaciones inmediatas a ET, SIVIGILA, VIGIFLOW y CNE del MSPS. Lo recomendado es que el seguimiento del día 30 coincida con el control prenatal de la gestante.
1.12 Verificar que las EAPB garanticen el talento humano en salud, de su red de atención contratada o propia para realizar el seguimiento y registro de las condiciones de salud de la población gestante vacunada contra la fiebre amarilla entre los días 15 y 18 y día 30 posterior a la vacunación, para identificar signos y síntomas sospechosos de EAPV, y generen la atención domiciliaria u hospitalaria pertinente y oportuna, así como las respectivas notificaciones inmediatas a ET, SIVIGILA, VIGIFLOW y CNE del MSPS, incluyendo las gestantes vacunadas inadvertidamente. Estos seguimientos deben quedar registrados en PAIWEB en el Módulo de Cohortes, de manera obligatoria. Además de colaborar en las investigaciones a nivel territorial, para EAPV de gestantes, así como, del feto o del hijo de madre vacunada contra la fiebre amarilla, hasta el primer año de vida.
1.13 Difundir el formato de “CONSENTIMIENTO/DISENTIMIENTO INFORMADO, ENCUESTA PREVIA Y SEGUIMIENTO PARA LA VACUNACIÓN CONTRA LA FIEBRE AMARILLA EN POBLACIÓN GESTANTE A PARTIR DE 12 SEMANAS DE GESTACIÓN QUE HABITE O TRANSITE EN ÁREAS DE MUY ALTA CIRCULACIÓN Y TRANSMISIBILIDAD DEL VIRUS” para la vacunación contra la fiebre amarilla en población gestante a partir de 12 semanas, la encuesta previa a la vacunación y el seguimiento posvacunal, anexo a la presente circular, cuyo diligenciamiento debe estar a cargo de los profesionales de la salud de las IPS (médico), incluido los médicos de los equipos básicos de salud, siendo un requisito previo a la vacunación. Este anexo que hace parte integral de la presente Circular, será suministrado por parte del MSPS a las Entidades Territoriales departamentales y distritales, quienes serán responsables de su socialización y capacitación.
1.14 Verificar que las EAPB garanticen el talento humano en salud, de su red de atención contratada o propia para realizar el seguimiento, valoración y registro de las condiciones de salud de hijos de gestantes vacunadas con FA e hijos de madres vacunadas con FA en periodo de lactancia antes de 6 meses de edad cronológica del bebé, incluyendo los hijos de gestantes vacunadas inadvertidamente, desde el nacimiento y mínimo de manera trimestral hasta el primer año de edad. Estos seguimientos deben quedar registrados en PAIWEB en el Módulo de Cohortes, de manera obligatoria.
1.15 Diseñar e implementar las estrategias de información y comunicación en salud a nivel regional para promocionar la vacunación de la dosis única de FA de la población gestante expuesta en zonas con muy alta circulación y transmisión del virus, para fortalecer la búsqueda de esta población susceptible.
1.16 Elaborar, implementar y evaluar un plan de comunicación de riesgo y comunicación asertiva para la salud que incluya la vacunación de la población gestante contra la fiebre amarilla y de sus hijos, así como, el plan de crisis, ante alguna eventualidad.
1.17 Consolidar y enviar al MSPS 1. Reporte inmediato de EAPV graves. 2. Informe de EAPV leves y graves y reporte de indicadores con periodicidad mensual. 3. Informe mensual de seguimientos realizados a la población gestante.
1.18 Dar cumplimiento a los siguientes Indicadores:
Tabla 1. Indicadores de seguimiento a las acciones de vigilancia pública.
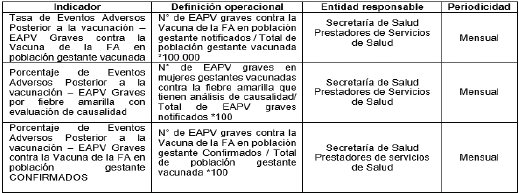
Tabla 2. Indicadores de seguimiento a la atención de las gestantes vacunadas y sus hijos
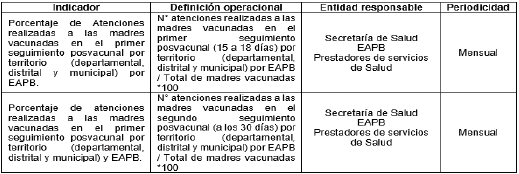
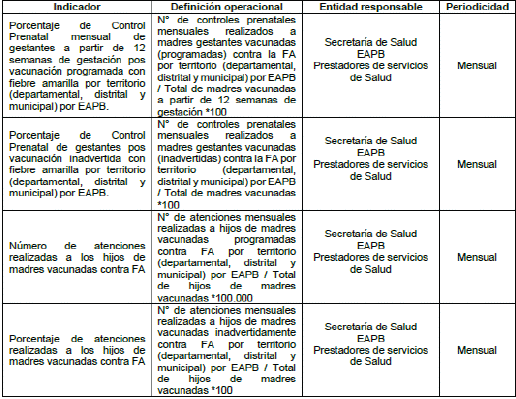
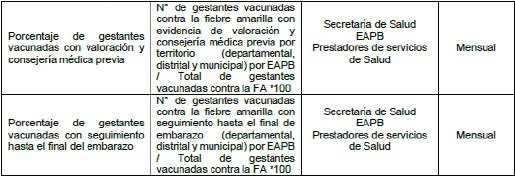
Tabla 3. Indicadores de Proceso
2. A las Entidades Promotoras de Salud, Entidades Adaptadas, Entidades que Administran Planes Voluntarios de Salud, Entidades que Administran los Regímenes Especial y de Excepción.
2.1. Las EPS/EAPB deberán cumplir con lo referido por la Constitución colombiana y la Corte Constitucional que reconocen que toda madre tiene el derecho fundamental a una maternidad segura, su monitoreo, seguimiento, atención del parto, atención de complicaciones, acceso a tecnologías y medicamentos que se requieran.
2.2. Participar en la elaboración de la microplanificación del territorio, en conjunto con la ET departamental y municipales y la red prestadora de servicios de salud, para garantizar la capacidad instalada para el desarrollo de las acciones de vacunación a través de estrategias (extramural e intramural) y tácticas de impacto acordes al territorio, incluido el barrido documentado, para asegurar coberturas de vacunación contra la FA del 95% en la población gestante a partir de 12 semanas de gestación y que cumpla con las características antes descritas.
2.3. Garantizar la vacunación sin barreras, atención en salud y seguimiento respectivo de la población gestante vacunada contra la fiebre amarilla (tanto a la vacunada programada como aquellas gestantes vacunadas inadvertidamente) y los hijos de madres vacunadas con este biológico, de acuerdo con las indicaciones dadas en la presente circular, dando cumplimiento a la Ley 2406 de 2024 “por medio de la cual se ordena la Modernización y Actualización permanente del Programa Ampliado de Inmunizaciones (PAI) (…)”.
2.4. Garantizar a través de su red de prestación de servicios, sea de su red de atención contratada o propia, el talento humano profesional en medicina, capacitado para realizar la valoración médica individualizada riesgo/beneficio de la población gestante a vacunar contra la fiebre amarilla con el fin de identificar antecedentes y condiciones de salud que pudiesen contraindicar la vacunación, propendiendo por el control de reacciones anafilácticas y eventuales EAPV.
2.5. Garantizar a través de las IPS la disposición de copias físicas para el diligenciamiento del formato “CONSENTIMIENTO/DISENTIMIENTO INFORMADO, ENCUESTA PREVIA Y SEGUIMIENTO PARA LA VACUNACIÓN CONTRA LA FIEBRE AMARILLA EN POBLACIÓN GESTANTE A PARTIR DE 12 SEMANAS DE GESTACIÓN QUE HABITE O TRANSITE EN ÁREAS DE MUY ALTA CIRCULACIÓN Y TRANSMISIBILIDAD DEL VIRUS”, anexo a la presente circular, cuyo diligenciamiento debe estar a cargo de los profesionales de la salud de las IPS (médico), siendo un requisito previo a la vacunación.
2.6. Garantizar través de su red de prestación de servicios, sea de su red de atención contratada o propia, el talento humano profesional en medicina, capacitado, para realizar seguimiento y registro de las condiciones de salud de la población gestante entre el día 15 y 18 y día 30 posterior a la vacunación, dejando constancia de cada seguimiento y registro en PAIWEB en el módulo de cohortes, de manera obligatoria, incluyendo también a las gestantes vacunadas inadvertidamente, para identificar, evaluar y reportar signos y síntomas sospechosos de EAPV y llevar a cabo la atención domiciliaria u hospitalaria pertinente y oportuna. Lo recomendado es que el seguimiento del día 30 coincida con el control prenatal de la gestante. Verificar e indicar la ruta para que las EAPB (IPS) dejen constancia de cada seguimiento posvacunación de las gestantes vacunadas e hijos.
2.7. Asegurar la atención en salud y las notificaciones a la ET, CNE de MSPS, SIVIGILA y al VIGIFLOW por parte de los Prestadores de Servicios de Salud en caso de presentarse un EAPV grave por vacuna contra la fiebre amarilla, incluyendo muerte, en población gestante vacunada programada a partir de 12 semanas de gestación; gestantes vacunadas inadvertidamente e hijos de madres vacunadas con este biológico dando cumplimiento a todas las instrucciones dadas en los protocolos de Vigilancia para FA del INS y de EAPV del INVIMA.
2.8. Hacer seguimiento al reporte diario por parte de los prestadores de servicios de salud de las dosis aplicadas contra la FA en la población gestante a través del reporte administrativo por PAIWEB.
2.9. Informar, difundir, motivar y orientar sobre el riesgo existente a la población y realizar demanda inducida para asegurar la vacunación de la población gestante en zonas de circulación activa del virus.
2.10. Realizar seguimiento activo al avance de la población gestante vacunada contra la FA en el marco y en cumplimiento del Plan de Acción Territorializado y verificar el registro diario de dosis y observaciones pertinentes, en el sistema de información nominal de vacunación PAIWEB por parte de sus prestadores garantizando el registro del 100% de las dosis aplicadas.
2.11. En caso de muerte neonatal o muerte perinatal como resultado de un EAPV, la EAPB será la responsable a través de su red de prestadores de asegurar la realización de la necropsia clínica, tomar las muestras que se requieran y enviarlas para su análisis al Instituto Nacional de Salud.
2.12. Garantizar que las IPS implementen y cumplan de manera inmediata la ruta de seguimiento posvacunación de las gestantes vacunadas e hijos y dejen constancia de la atención brindada en historia clínica.
2.13. Dar cumplimiento a los siguientes Indicadores:
Tabla 3. Indicadores seguimiento de vacunación
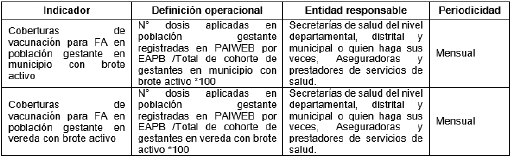
3. A las Instituciones Prestadoras de Servicios de Salud Públicas, Privadas y Mixtas.
3.1. Realizar la búsqueda y ofrecer la vacunación contra la fiebre amarilla a la población gestante que no ha sido vacunada contra la FA, a partir de las 12 semanas de gestación, residente o que no le sea posible evitar la permanencia o desplazamiento a veredas con circulación activa del virus de FA, es decir las veredas con evidencia de casos humanos o epizootias en los últimos seis meses, incluyendo las establecidas en el corredor eco epidemiológico. Para la vacunación de las gestantes se requiere valoración médica individualizada de riesgo/beneficio y diligenciamiento del consentimiento/disentimiento informado previa a la aplicación de la vacuna, verificando que no se encuentre en situación de salud que contraindique la vacunación según la encuesta previa a la vacunación, mediante el formato anexo a la presente circular: “CONSENTIMIENTO/DISENTIMIENTO INFORMADO, ENCUESTA PREVIA Y SEGUIMIENTO PARA LA VACUNACIÓN CONTRA LA FIEBRE AMARILLA EN POBLACIÓN GESTANTE A PARTIR DE 12 SEMANAS DE GESTACIÓN QUE HABITE O TRANSITE EN ÁREAS DE MUY ALTA CIRCULACIÓN Y TRANSMISIBILIDAD DEL VIRUS”.
3.2. Realizar la microplanificación, estableciendo las estrategias y tácticas necesarias para garantizar coberturas de vacunación de las gestantes contra la FA del 95% (barrido documentado, concentración, casa a casa, entre otras) de acuerdo con las características del territorio.
3.3. La madre gestante recibirá la asesoría durante la atención prenatal, sobre el abordaje de riesgo/ beneficios de la vacunación de fiebre amarilla por su lugar de residencia en la zona de muy alta circulación viral y brote activo. En caso de mujeres que planean un embarazo, se recomienda retrasar cuatro semanas la concepción después de la vacunación contra la fiebre amarilla.
3.4. El consentimiento/disentimiento informado se diligenciará de manera obligatoria. En caso de que, la madre no puede cuidar de sí misma o administrar sus asuntos debido a incapacidad mental o sea por minoría de edad o por discapacidad, el tutor legal deberá firmar la autorización por la madre gestante.
3.5. Es fundamental para garantizar un embarazo saludable para la madre realizar la demanda inducida al control prenatal asegurando un mínimo de 6 controles prenatales regulares y seguimiento posterior de la vacunación de fiebre amarilla.
3.6. En gestantes vacunadas contra la fiebre amarilla, tendrán consulta prioritaria en el sistema de salud sin ninguna barrera, sin limitaciones en el número de controles, sea de urgencias o de consulta electiva.
3.7. El feto o recién nacido, deberá tener seguimiento por La Ruta Materno Perinatal durante el ciclo de vida y ser relacionado como hijo de madre vacunada con fiebre amarilla durante la gestación hasta el primer año de vida.
3.8. En caso de haber vacunado a una madre en los últimos 10 días previos al parto, se deberá informar que no debe lactar a su hijo recién nacido, pero posteriormente a los 10 días posteriores a la vacunación, podrá iniciar la lactancia materna. En las madres lactando niños mayores de 6 meses, no es necesario suspender la lactancia materna posterior a la vacunación contra la fiebre amarilla.
3.9. Garantizar la suficiencia de talento humano profesional en medicina, incluido médico de los equipos básicos en Salud, capacitado para realizar la valoración médica individualizada riesgo/beneficio de la población gestante a vacunar contra la fiebre amarilla con el fin de identificar antecedentes y condiciones de salud que pudiesen contraindicar la vacunación, propendiendo por el control de reacciones anafilácticas y eventuales EAPV.
3.10. Realizar a través del profesional en medicina, capacitado, para realizar seguimiento y registro de las condiciones de salud de la población gestante entre el día 15 y 18 y día 30 posterior a la vacunación, dejando constancia de cada seguimiento y registro en PAIWEB en el módulo de cohortes, de manera obligatoria, incluyendo también a las gestantes vacunadas inadvertidamente, para identificar signos y síntomas sospechosos de EAPV y se genere la atención domiciliaria u hospitalaria pertinente y oportuna. Lo recomendado es que el seguimiento del día 30 coincida con el control prenatal de la gestante.
3.11. La valoración médica de la gestante vacunada con fiebre amarilla debe realizarse solo por el médico; quién monitoreará el progreso del embarazo y detectará eventuales desviaciones del curso de la gestación y brindará la educación y apoyo necesario. Según el protocolo que defina el INVIMA se deberá registrar la situación de salud de la madre y el feto durante el seguimiento al menos una vez cada trimestre en las herramientas definidas en dicho protocolo. Es fundamental que se registre el desenlace del embarazo para las actividades de Farmacovigilancia.
3.12. Disponer de la logística para el desplazamiento en articulación con la ET y la EAPB, para la valoración médica individualizada riesgo beneficio y para la vacunación, en zona rural, cuando se dificulte el traslado de la madre gestante a la consulta prenatal.
3.13. Realizar la capacitación, inducción o reinducción del Talento Humano (médico) que va a realizar la valoración médica individualizada riesgo beneficio y el diligenciamiento del formato previo a la vacunación de las gestantes en zonas de circulación activa, con el fin de identificar antecedentes y condiciones de salud que pudiesen contraindicar la vacunación.
3.14. La gerencia de la IPS deberá implementar, de forma inmediata, el procedimiento de atención prenatal de gestantes vacunadas contra la fiebre amarilla y la atención de sus hijos identificados como “hijo de madre vacunadas contra la FA”, en sus protocolos institucionales.
3.15. Iniciar de forma inmediata, capacitación en el lineamiento de atención prenatal de gestantes vacunadas contra la FA y el protocolo de vigilancia de la FA dirigidos al personal asistencial antiguo y nuevo de medicina general, especialistas y enfermería hasta garantizar una cobertura del 100% de los profesionales.
3.16. Generar la estandarización de procesos y procedimientos que permitan la articulación con las actividades y acciones de los Equipos Básicos de Salud del territorio en la atención de las gestantes.
3.17. Se debe reorganizar la planificación de los equipos básicos para responder a las necesidades que surjan durante los brotes de fiebre amarilla, incluyendo la valoración médica individualizada riesgo beneficio, la vacunación y la consulta prenatal de gestante vacunada contra la fiebre amarilla.
3.18. Las IPS deberán implementar de manera inmediata la ruta de seguimiento posvacunación de las gestantes vacunadas e hijos y dejar constancia de la atención brindada en historia clínica.
3.19. Realizar la atención en salud y las notificaciones a la ET, CNE de MSPS, SIVIGILA y al VIGIFLOW en caso de presentarse un EAPV grave por vacuna contra la fiebre amarilla, incluyendo muerte, en población gestante vacunada programada a partir de 12 semanas de gestación; gestantes vacunadas inadvertidamente e hijos de madres vacunadas con este biológico dando cumplimiento a todas las instrucciones dadas en los protocolos de Vigilancia para FA del INS y de EAPV del INVIMA, disponibles en:
- Protocolo de Vigilancia de FA del INS, disponible en https://www.ins.gov.co/ buscador-eventos/Lineamientos/310_F_Amarilla_2024.pdf y https://www.ins.gov.co/buscador-eventos/Lineamientos/Pro_Fiebre%20amarilla%202024.pdf
- Lineamiento de Eventos Adversos Posteriores a la Vacunación - EAPV del INVIMA, disponible en:
https://www.invima.gov.co/sites/default/files/medicamentos-productos-biologicos/Medicamentos%20de%20s%C3%ADntesis%20qu%C3%ADmica%20y%20biol%C3%B3gica/Vigilancia/Programa-Nacioal-de-Farmacovigilancia/Formatos-tramites-y-guias/2024/Lineamientos%20vacunacio%CC%81n%20EAPV.pdf
3.20. Generar la atención intramural y extramural pertinente y oportuna según corresponda en caso de EAPV, así como la respectiva notificación inmediata en SIVIGILA del INS como un caso probable de fiebre amarilla; si corresponde a un evento grave, y simultáneamente en la plataforma VIGIFLOW del INVIMA, además de comunicar de manera inmediata a la Dirección Local de Salud y al CNE del MSPS.
3.21. El INVIMA acompañará y apoyará a las instituciones prestadores de servicios de salud diseñando los mecanismos, procedimientos y protocolos para desarrollar la Farmacovigilancia Activa en seguimiento a las posibles EAPV que pueda presentar población gestante programada a partir de 12 semanas de gestación con la vacuna de la fiebre amarilla.
3.22. Reportar diariamente a las ET correspondientes, las dosis aplicadas de vacuna contra la FA en la población gestante a través del reporte administrativo por PAIWEB.
3.23. Registrar de manera obligatoria y oportuna las dosis aplicadas de vacuna contra la FA en gestantes en el sistema de información nominal nacional PAIWEB, garantizando la calidad del dato y completitud del diligenciamiento del total de variables, haciendo énfasis en la actualización de los datos de residencia de la usuaria (departamento, municipio, comuna, área - urbana, rural, rural disperso).
3.24. Verificar antecedente de vacunación contra la FA a través del carné de vacunación en físico, registros del archivo institucional o a través de sistemas de información y actualizar por registro histórico en PAIWEB. Si no se evidencia el antecedente vacunal en la gestante, se indica la aplicación del biológico de no haber contraindicación, luego de la evaluación médica riesgo beneficio y el consentimiento de la gestante.
3.25. Las IPS deberán disponer copias físicas del formato de “CONSENTIMIENTO/DISENTIMIENTO INFORMADO, ENCUESTA PREVIA Y SEGUIMIENTO PARA LA VACUNACIÓN CONTRA LA FIEBRE AMARILLA EN POBLACIÓN GESTANTE A PARTIR DE 12 SEMANAS DE GESTACIÓN QUE HABITE O TRANSITE EN ÁREAS DE MUY ALTA CIRCULACIÓN Y TRANSMISIBILIDAD DEL VIRUS”, anexo a la presente circular, para garantizar el diligenciamiento previo a la vacunación por parte del médico de la IPS incluido el médico de los equipos básicos de salud y demás personal profesional disponible en cada territorio, siendo un requisito obligatorio previo a la vacunación de la población gestante.
3.26. Salvaguardar la información de las gestantes vacunadas, los soportes previos a la vacunación y los soportes de seguimiento al estado de salud posvacunación, así como la información de EAPV no graves y graves notificados.
3.27. Para el cálculo de los indicadores, es obligatorio realizar el registro en PAIWEB de las dosis aplicadas a las gestantes vacunadas, así como, los motivos de no vacunación y los seguimientos posvacunación.
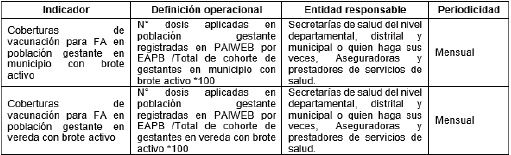
3.28. Dar cumplimiento a los siguientes Indicadores:
Tabla 4. Indicadores seguimiento de vacunación
4. Inspección Vigilancia y Control de la Superintendencia Nacional de Salud.
La Superintendencia Nacional de Salud ejercerá las funciones de inspección, vigilancia y control frente al cumplimiento de las obligaciones a cargo de los actores involucrados en la presente circular y de la gestión integral de acuerdo con la normatividad vigente.
Publíquese, comuníquese y cúmplase.
Dada en Bogotá, D. C., a 27 de agosto de 2025.
El Ministro de Salud y Protección Social,
Guillermo Alfonso Jaramillo Martínez
<Anexo publicado en el Diario Oficial>
<Consultar PDF del Diario Oficial directamente en el siguiente enlace:
https://normograma.com/documentospdf/PDF/C_MSPS_0029_2025_ANEXO.pdf
NOTAS AL FINAL:
1. https://iris.who.int/bitstream/handle/10665/246107/9789241580496-eng.pdf?sequence=1
2. https://www.paho.org/sites/default/files/2025-05/2025-mayo-31-phe-alerta-epidemiologica-fiebreamarilla-final.pdf
3. https://iris.who.int/bitstream/handle/10665/242091/WER8827-spa.pdf?sequence=25&isAllowed=y
4. Rad 2025423002573342 Posición de OPS sobre las indicaciones y contraindicaciones de la vacunación contra la fiebre amarilla y de la población de precaución.
5. INS – Concepto técnico “Vacunación contra fiebre amarilla en mujeres gestantes en el contexto de la Emergencia Sanitaria por brote de fiebre amarilla en Colombia”.
6. https://www.invima.gov.co/sites/default/files/medicamentos-productos-biologicos/Medicamentos%20de%20s%C3%ADntesis%20qu%C3%ADmica%20y%20biol%C3%B3gica/Vigi lancia/Programa-Nacioal-de-Farmacovigilancia/Formatos-tramites-y-guias/2024/Lineamientos%20vacunacio%CC%81n%20EAPV.pdf



